基因表达载体是广大科研人员普遍需要的研究工具,而病毒载体凭借其优良效能则越来越成为最受欢迎、也最为普遍的基因表达载体。然而病毒载体也分为好几类,不同实验类型、不同研究目的、不同“受体”性质需要我们准确评估与选择。因此,详细了解不同病毒载体的相关知识是我们科研人员必须掌握的。本文详细介绍了常见病毒载体的原理、特点和适用范围。
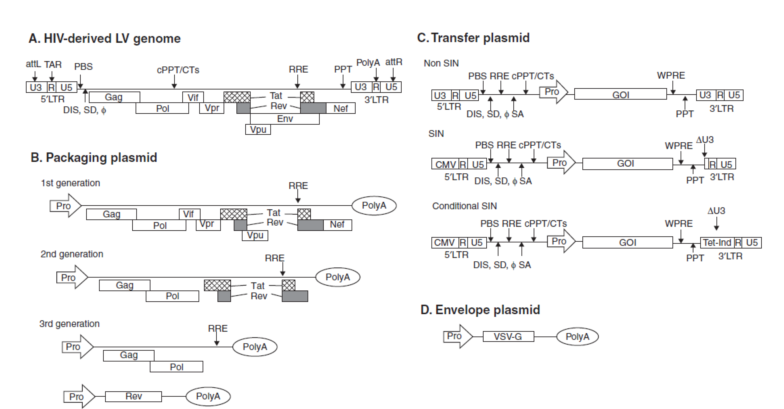
慢病毒(Lentivirus)属于逆转录病毒的一种,有由于其感染潜伏期较长,临床症状发展缓慢,被称为慢病毒。而慢病毒载体则是在慢病毒的基础上改变重组其构成原件,进而在去除其生物危害性的同时,利用其高感染等性能表达目的基因。人类免疫缺陷病毒(HIV)是常见的慢病毒载体改造原型。如下以HIV中最为常见的HIV-1型:
HIV-1为双链RNA病毒,主要组分包含三种重要病毒核心基因:gag(编码结构蛋白或称为核心蛋白),pop(编码复制相关酶类),env(编码包膜糖蛋白);调节基因:tat(转录控制)和rev(表达调节);四个辅助基因:vif、vpr、vpu、nef(作为毒力因子参与宿主细胞的识别和感染);两端为长末端重复序列LTR (内含复制所需的顺式作用元件)。
第一代慢病毒载体为双质粒系统,基本保留了HIV的所有组件,产毒滴度低,复制缺陷,且存在产生复制能力的活性HIV病毒的可能;第二代慢病毒载体为三质粒系统,分为包装质粒、包膜质粒和载体质粒,其中使用水泡性口炎病毒糖蛋白(VSV-G)基因替代env基因,拓宽了病毒的感染宿主细胞范围,虽然三质粒降低了病毒重组的可能,但是由于其依然保留HIV大部分附属基因,产生活性HIV依然存在可能;第三代慢病毒载体则去除了HIV病毒所有辅助序列,只保留核心的3个基因(gag、pol、rev),病毒RNA不能转录,故意外重组的可能性很低;第四代慢病毒载体为四质粒系统,即将病毒核心基因分散在多个质粒中(pGag/Pol、pRev、pVSV-G和载体质粒),同时去除tat,故病毒重组、产生活性病毒的可能进一步降低,同时四质粒系统中的载体质粒中可以包含可诱导基因,使得该基因表达系统可以条件性调控。
慢病毒载体感染能力强、且宿主广泛(分裂和非分裂细胞);能够整合进宿主DNA且筛选后稳定遗传;表达潜伏期短,一般细胞24h-48h、体内96小时可表达;慢病毒载体可以插入组织特异性启动子或增强子;慢病毒携带基因的长度大致无5kb以内。由于慢病毒依然是HIV来源,自然宿主是人,依然存在潜在的生物毒性,故操作时避免直接接触人体。慢病毒载体适合常见类型的体外研究(细胞),包括过表达、敲除、敲低都基因干预操作,但慢病毒载体不适合于体内研究,因为其滴度不能够满足体内用量且免疫原性较强。
(Expert Opin Biol Ther. 2013 Jul;13(7):987-1011. doi:10.1517/14712598.2013.779249.)
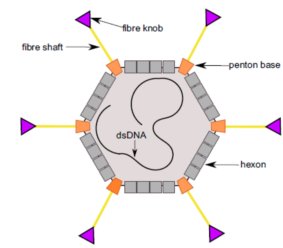
腺病毒(Adenovirus)是一种线性无包膜的双链DNA病毒,腺病毒的衣壳结构可以分为五邻体和六邻体两部分,腺病毒的基因组主要包括病毒DNA复制前期的Ela、Elb、E2a、E2b、E3、E4(编码病毒调节蛋白)和DNA复制后期的Ll~L5(编码病毒结构蛋白),以及两端的反向重复序列,ITRs(包装所必需的顺式作用元件)。
在天然腺病毒(主要是人5型腺病毒)的基础上改造而得的腺病毒载体,其基因携带量增加,感染效率增加,且生物毒性降低。第一代腺病毒载体是删除Ela、Elb基因的复制缺陷病毒,其复制必须在表达E1蛋白的细胞中,病毒滴度高且稳定,不整合宿主基因组,但包装量少(约为4.5kb),免疫原性强;第二代腺病毒载体进一步删减病毒原有基因,在减少免疫原性和细胞毒性的同时,进一步提高载体容量,可以达到14kb,但是病毒滴度较低;第三代腺病毒载体则只保留了ITRs和包装信号序列,因此其携带外源基因容量更大,约36 kb,但由于病毒包装基因必须基因被删除,第三代腺病毒载体工作组装需要辅助病毒(表达腺病毒装配必须基因),第三代腺病毒载体容量大,免疫原性低,但是量产困难,存在辅助病毒污染风险。
腺病毒感染力强、宿主范围广(分裂和非分裂细胞),表达迅速(24h-48h)且表达量高,包装容量大,但腺病毒不能整合入宿主基因组内,规避了整合入宿主基因组的生物风险,安全的同时也形成了细胞分裂过程中不能均等分配给子细胞。腺病毒载体适合一般体外实验,使用细胞类型较多,免疫原性较强,不适合体内实验。
(Med Microbiol Immunol. 2020 Jun;209(3):325-333. doi: 10.1007/s00430-019-00645-2)
(Eur J Cell Biol. 2012 Jan;91(1):2-9. doi: 10.1016/j.ejcb.2011.01.006)
腺相关病毒(Adeno-associated virus,AAV)是无包膜单链线状DNA 缺陷型病毒,外包二十面体衣壳蛋白,基因组包括两端的反向重复序列ITR(包含复制和包装所需的唯一顺式作用元件),中间的两个核心基因:Rep 基因(编码参与病毒复制、包装和基因整合的蛋白),Cap(编码结构蛋白VP1、VP2、VP3)。AAV为复制缺陷病毒,不能独立存在,其复制增殖需要辅助病毒作用。衣壳蛋白不同的AAV病毒,对组织器官的亲和力不同,形成各种AAV血清型:如AAV1较易感染骨骼肌,AAV6较易感染肺部,AAV8则亲嗜肝脏,AAV9则为神经和外周组织(见后表)。
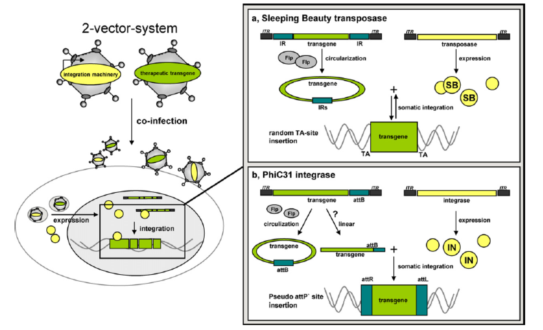
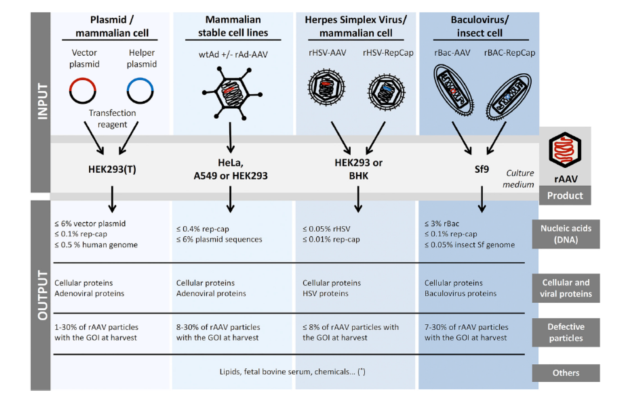
腺相关病毒载体(重组腺相关病毒载体, rAAV)的发展同样在天然AAV的基础上不断优化改进。最早采用重组载体质粒、目的基因质粒、辅助质粒、腺病毒共转染细胞,步骤多、产率低、风险高;随后采用目的基因载体、AAV基因载体(rep/cap)、辅助质粒(包含E1a、E1b、E2a、E4、VA等能完成腺病毒相似辅助功能的基因元件)共转染细胞,但包装效率低,生物风险高;Ad/AAV嵌合载体、辅助质粒感染恒定表达Rep/Cap细胞系的方法以及AAV生产细胞系法,这些方法均操作繁琐;目前最常用的载体方法为Bac-to-Bac杆状病毒表达系统:将rAAV包装组分AAV2的Rep基因序列、Cap基因序列、以及ITR-目的基因表达框的序列分别构建到三个杆状病毒中,分别转染昆虫细胞Sf9各自扩增,然后通过共感染Sf9细胞来生产rAAV,该方法可以量产、成本低、操作简单且不会对人体产生损伤。
AAV载体免疫原性极低,非常适合动物实验,感染效率高,宿主范围广(分裂和不分裂细胞),不整合到基因组,稳定表达持续时间长(半年以上),但是表达水平低且慢(细胞需要1周,动物需要2周),携带目的基因片段约为2kb。
(Mol Ther Methods Clin Dev. 2018 Jan 8;8:166-180. doi: 10.1016/j.omtm.2018.01.002)
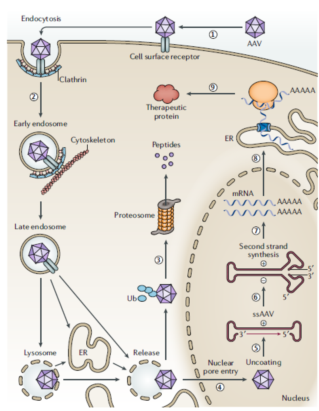
(Nat Rev Genet. 2020 Apr;21(4):255-272. doi: 10.1038/s41576-019-0205-4.)
表1显示的是不同血清型的AAV载体不同的特性比较,对于我们基础体内实验来说,重点关注其血清型对组织的亲和力就可以,即表格中的tissue tropism(组织嗜性),在感染不同组织,即体内研究中载体具体针对组织时,要选择高亲和力的AAV血清型。
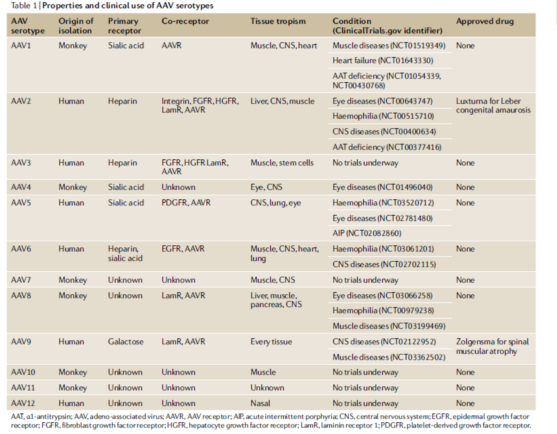
(Nat Rev Genet. 2020 Apr;21(4):255-272. doi: 10.1038/s41576-019-0205-4.)














